
Wir bieten Ihnen fundierte Antworten auf Ihre Fragen an.
Branchenkenntnisse und Know-how über die regulatorischen Anforderungen sind ein Muss, um die beste passende Strategie festzulegen, welche den gesamten Clinical Product Lifecyle abdeckt. Mehr als 15 Jahre Erfahrung ermöglichen es uns, Ihnen die Unterstützung zu bieten, die Sie benötigen. Sorgfälltig berücksichtigen wir Ihre Produktideen, Entwicklungen, Indikationen und Claims aber auch das Marktumfeld, während eine Produktpriorisierung mit Portfolioanalyse, Marktforschung oder Wettbewerbsanalyse durchgeführt wird.
GAP-analyse fehlt.
Unterschied Consulting/Workshop muss klarer werden.
Consulting: Wenige (1-3) individuell Teilnehmer, seitens Kunde.
Workshop: Viele Teilnehmer / teils Frontalveranstaltung, teils Arbeitspakete in Gruppen bearbeitend.
Wir unterstützen Sie bei der Entwicklung einer klinisch-regulatorischen Strategie einschließlich der Optimierung Ihrer Prozesse und Produktpipeline. Gemeinsam analysieren wir:
- Business Development
- Produktportfolio und Produktlebenszyklen
- MDR-Implementierung
- Ziele und Methoden klinischer Prüfungen und Bewertungen

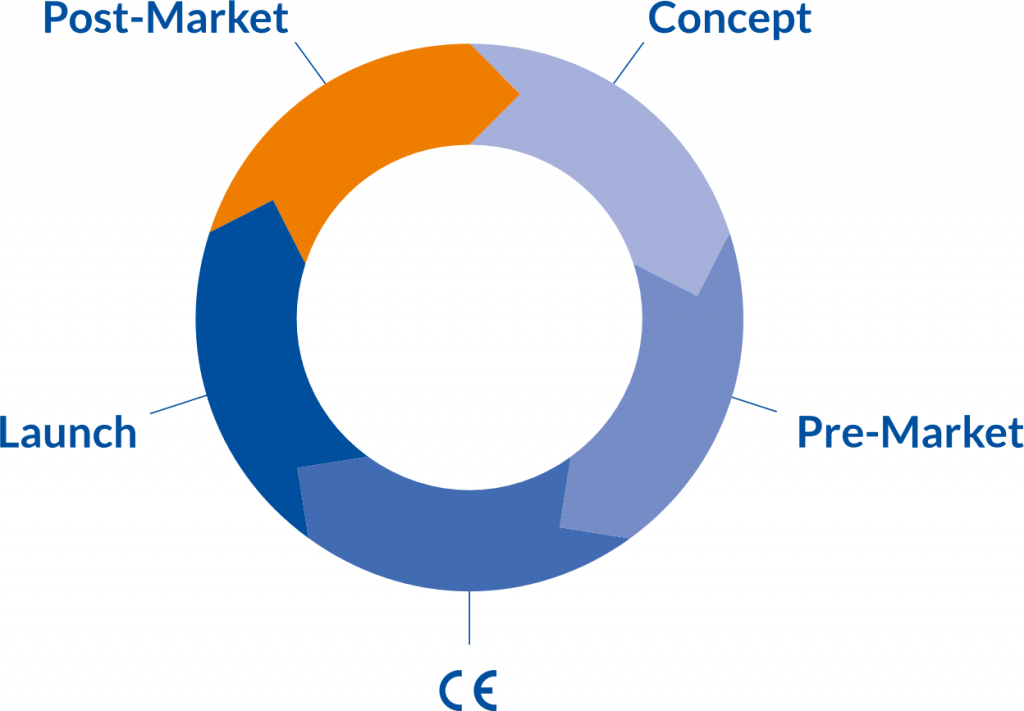
Clinical Product Lifecycle
Technologische und digitale Neuerungen in Kombination mit hohen regulatorischen Anforderungen wie der MDR (EU) 2017/745 prägen die Medizinprodukteindustrie. Als Hersteller stehen Sie heute vor enormen Herausforderungen. Die MDR (EU) 2017/745 weißt dem klinischen Produktlebenszyklus (Clinical Product Lifecycle) ein deutlich höheres Gewicht zu. Produktinnovationen erfordern früh eine klare und zielorientierte „klinische Ausrichtung“. Um erfolgreich zu sein, sind Marketingaspekte und Claims zu berücksichtigen. Hinsichtlich der klinischen Bewertung ist es gemäß Anhang XIV der MDR erforderlich, einen klinischen Entwicklungsplan (Clinical Development Plan, CDP) zu erstellen, der zahlreiche Angaben und Aufgaben umfasst „von explorativen Studien, wie Studien zur Erstanwendung am Menschen („First-in-man“-Studien), Durchführbarkeitsstudien und Pilotstudien bis hin zu Bestätigungsstudien, wie pivotale klinische Prüfungen, und einer klinischen Überwachung nach dem Inverkehrbringen“.
Wir bieten Ihnen Unterstützung zur Entwicklung einer Strategie und effizienten Umsetzung des Clinical Product Lifecycles.
Warum?
Eine eingehende Analyse unterstützt Sie in der Entscheidungsfindung, die etwa in einer klinisch-regulatorischen Strategie mündet. Diese zeigt greifbare Maßnahmen auf, von der zielorientierten Schulung Ihrer Mitarbeiter und des Studienteams, über die CEP-Realisierung, bis hin zur Definition der Entwicklungspipeline samt deren Planung hinsichtlich Vermarktung und Finanzierung.

Die effektive Identifikation und Umsetzung geeigneter Maßnahmen kann Führungskräfte und Investoren einbinden.


